Equilibrios de Oxido Reduccion
Las reacciones de óxido reducción son aquellas en las que sucede un intercambio de electrones de tal manera que hay un cambio en los estados de oxidación de las especies involucradas (posible cita). Su tratamiento puede darse enfocado en el cambio de potencial estándar como del potencial de electrones .
Enfoque – Potencial estándar de Reducción
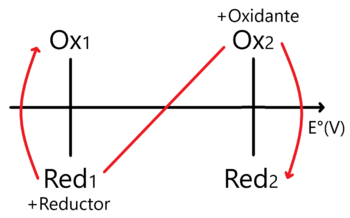
En este caso la regla de la N vista para sistemas Ácido - Base (posible link) se invierte en comparación a como la usamos en Ácidos y Bases.
Nótese que en este caso ubicamos al Oxidante más fuerte en la parte superior derecha y al Reductor más fuerte en la inferior izquierda. En este sentido encontraremos el Proceso Espontáneo y cuya constante de equilibrio se encuentra como:
Donde hemos de sustituir n1 y n2 como los electrones intercambiados por semirreacción involucrada.
Sólo en caso de que n1 = n2 sustituimos a uno sólo de estos.
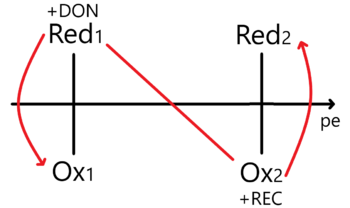
Enfoque – Potencial de electrones
Aquí es necesario plantear un equilibrio considerando una concentración de electrones. Para una reacción de la forma:
Planteamos la constante de equilibrio y luego despejamos a la concentración de electrones para aplicarle el cologaritmo correspondiente. Así obtenemos un potencial de electrón de tal manera que...
La relación entre el potencial de electrones y el estándar de reducción viene dada por la ecuación:
Ecuación de Nerst
Aplica sólo para semirreacciones, de tal manera que:
Ejemplos
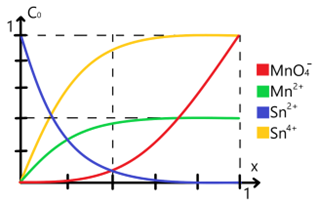
Ejemplo: Titulación de una solución de estaño con permanganato
Para ejemplificarlo supongamos un sistema donde usamos permanganato para valorar o titular una solución de iones de estaño para lo cual consideramos los potenciales estándar de reducción para cada una de las especies involucradas; la propia facultad de química de la UNAM tiene una tabla con los valores de potenciales estándar de reducción para muchas especies distintas para lo cual consideraremos los valores de +1.51 eV para el par y de +0.15 eV para el par .
Entonces las semirreacciones a considerar son:
Entonces planteamos la siguiente reacción:
Si tienes dudas sobre cómo llegamos a esta conclusión considera revisar el tema balanceo ion electrón.
Para encontrar un gráfico de la variación de las especies implicadas respecto al avance de la reacción es necesario antes realizar la tabla de variación de especies y analizarla de acuerdo a su respectiva tabla de variación de especies. A continuación te muestro dicha tabla simplificada (eliminamos a la concentración de protones porque decido ignorar el pH, así como la de agua porque asumimos que se encuentra en exceso):
Nótese que aparecen amortiguadores cuando [Sn(2+)* = [Sn(4+)] y [MnO4(-)] = [Mn(2+)]. En estos casos podemos hacer uso del cálculo de potencial en el punto de equivalencia el cual se obtiene como:
Error al representar (error de sintaxis): {\displaystyle \[ E = \frac{n_1 E_1^\circ + n_2 E_2^\circ}{n_1 + n_2} + \frac{0.06}{n_1 + n_2} \log\left( \frac{[\text{Ox}_1]^a [\text{Ox}_2]^b}{[\text{Red}_1]^a [\text{Red}_2]^b} \right) \] }
¡¡¡Recuerde que debe de sustituir los datos por semirreacción y no por la reacción global!!!
El análisis de potencial debe de llevarse a cabo considerando tres zonas. Por ejemplo, para la reacción:
Error al representar (error de sintaxis): {\displaystyle \[ 6\,\text{Fe}^{2+}_{\text{analito}} + \text{Cr}_2\text{O}_7^{2-}_{\text{titulante}} \rightleftharpoons 2\,\text{Cr}^{3+} + 6\,\text{Fe}^{3+} \] }
· Al inicio sólo hay Fe(2+) por lo que el E(V) es indeterminado.
· Antes del Punto de Equivalencia (APE) hay Fe(2+) y Cr(3+), el potencial entonces lo impone el par
· En la equivalencia la reacción no es cuantitativa, entonces usamos:
Error al representar (error de sintaxis): {\displaystyle E=(n_1\ E°_1+n_2 E°_2)/(n_1+n_2 )+0.06/(n_1+n_2 ) log(([Ox_1 ]^a [Ox_2 ]^b)/([Red_1 ]^a [Red_2 ]^b ))}
· Después del Punto de Equivalencia (DPE) el par que impone el potencial es





![{\displaystyle [e^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/417d75f02ae885550bb2a7b50ac4cc5b3a770c10)

![{\displaystyle pe^{-}=\log _{10}{\frac {K_{eq}}{n}}+\log _{10}{\frac {[A]^{a}}{[B]^{b}[C]^{c}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/cc0b592017e699c50d97c18c32418b50ef1e27d7)


![{\displaystyle E=E^{o}+{\frac {0.06}{n}}*\log _{10}{\frac {[Ox]^{a}}{[Red]^{b}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/279d7f07c3399e106cf9349ccf06fa827afe56bd)