Diferencia entre revisiones de «Equlibrios de solubilidad-precipitación»
| Línea 28: | Línea 28: | ||
=Equilibrio de precipitación= | =Equilibrio de precipitación= | ||
Las reacciones de precipitación son aquellas en las que se formamos una especie química, cuya característica principal es su solubilidad limitada. Durante la reacción química, lo que sucede es que las especies reactivas en disolución inicia la formación de partículas extremadamente pequeñas, las cuales posteriormente crecen y finalmente se separan de a disolución. Esto se puede observar mediante la aparición de un sólido, llamado precipitado.<ref>W. F. Pickering."Química analítica moderna". Reverte | Las reacciones de precipitación son aquellas en las que se formamos una especie química, cuya característica principal es su solubilidad limitada. Durante la reacción química, lo que sucede es que las especies reactivas en disolución inicia la formación de partículas extremadamente pequeñas, las cuales posteriormente crecen y finalmente se separan de a disolución. Esto se puede observar mediante la aparición de un sólido, llamado precipitado.<ref>W. F. Pickering.(2021) "Química analítica moderna". Reverte. - Science. México. pp: 453-456</ref> | ||
En dichas reacciones estudiamos los '''equilibrios de precipitación'''. Este tipo de equilibrios se definen como aquellos que se establecen cuando se adiciona a una especie en disolución otra que puede formar un ''precipitado''. | En dichas reacciones estudiamos los '''equilibrios de precipitación'''. Este tipo de equilibrios se definen como aquellos que se establecen cuando se adiciona a una especie en disolución otra que puede formar un ''precipitado''. | ||
Revisión del 19:41 18 oct 2023
Introducción
En la química analítica existe un interés por el estudio de los equilibrios heterogéneos, los cuales son aquellos en donde sus especies reactivas y productos se encuentran en más de una fase. Esto es, en la reacción intervienen sustancias en diferentes fases en forma de sólido o líquido.
Dentro del estudio de los equilibrios heterogéneos tenemos a los equilibrios de precipitación-solubilidad.[1]
El interés por el estudio de estos equilibrios radica en:
- La separación selectiva de especies químicas, con base en sus diferencias de solubilidad.
- Realizar análisis cualitativos que permiten la identificación de especies químicas, como por ejemplo detectar la presencia de plomo en vasijas de barro.
- Algunos métodos analíticos clásicos como las gravimetrías nos permiten la determinación cuantitativa de especies químicas a partir de la capacidad de formar sustancias insolubles.
Solubilidad
La IUPAC define a la solubilidad de un soluto como “Es la composición analítica de una disolución saturada, expresada en términos de la proporción de un soluto designado en un disolvente designado. La solubilidad puede expresarse como concentración, molalidad, fracción molar, etc. " [2]
Si bien esta es una definición oficial, en otras palabras, es “La cantidad máxima de un soluto que puede disolverse en una cantidad dada de un disolvente a una determinada temperatura.” Para muchas sustancias, los valores de la solubilidad están reportados en tablas. Una forma muy común de encontrar los valores que describen cuantitativamente la solubilidad de un soluto es con el máximo número de gramos de soluto que pueden disolverse en una cantidad dada de disolvente. A partir de este dato, si conocemos la masa molar de esta sustancia, podremos expresar su solubilidad en mol por litro (mol/L o mol*L-1), a lo que se le conoce como solubilidad molar de un compuesto. Un soluto formado por iones, al disolverse en agua da lugar a cationes hidratados y aniones hidratados. En el caso particular de las sales iónicas que son poco solubles, se suele cuantificar su solubilidad mediante el estudio del equilibrio de producto de solubilidad que se representa como Kps.
Disolución saturada
La IUPAC la define como “Una disolución que tiene la misma concentración de un soluto que una que está en equilibrio con un soluto no disuelto a valores específicos de temperatura y presión.”[3]
Producto de solubilidad
La IUPAC define al equilibrio de solubilidad, también llamado producto de solubilidad, como el producto de las actividades iónicas elevadas a las potencias apropiadas de un soluto iónico en su disolución saturada, expresado con la debida referencia a los equilibrios de disociación implicados y a los iones presentes.[4]
Esta es una constante de equilibrio de la reacción de disociación de un sólido salino. En la constante de equilibrio de solubilidad durante los cálculos de equilibrios de especies iónicas con precipitación, la actividad de los sólidos en contacto con la disolución se considera como unitaria, por lo cual no es necesario escribirlo de forma explícita.
Equilibrio de precipitación
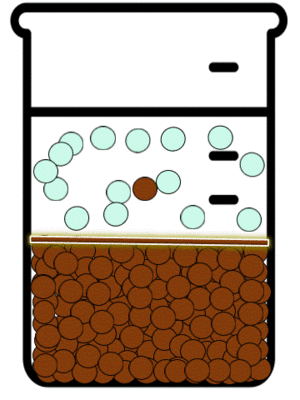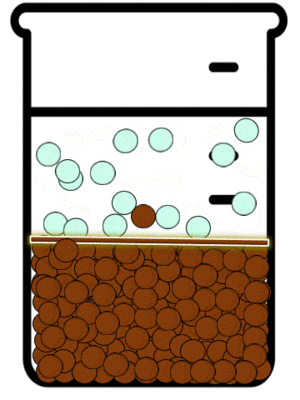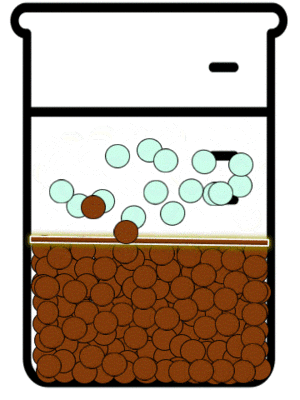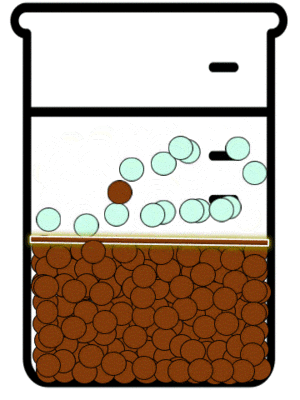
Las reacciones de precipitación son aquellas en las que se formamos una especie química, cuya característica principal es su solubilidad limitada. Durante la reacción química, lo que sucede es que las especies reactivas en disolución inicia la formación de partículas extremadamente pequeñas, las cuales posteriormente crecen y finalmente se separan de a disolución. Esto se puede observar mediante la aparición de un sólido, llamado precipitado.[5]
En dichas reacciones estudiamos los equilibrios de precipitación. Este tipo de equilibrios se definen como aquellos que se establecen cuando se adiciona a una especie en disolución otra que puede formar un precipitado.
Precipitación
Las sustancias iónicas solubles existen en disolución en la forma de aniones y cationes. Estos iones en disolución están en continuo movimiento y debido a ello interactúan momentáneamente. Dependiendo de que tan soluble sea en agua la sustancia a la que corresponden el catión y el anión, mientras no sea una disolución saturada, la interacción entre los iones no será suficiente como para producir agregados de iones en forma de sólidos cristalinos. La IUPAC define a La precipitación como “la sedimentación de un material sólido (un precipitado) a partir de una disolución líquida en la que el material está presente en cantidades superiores a su solubilidad en el líquido."[6]
Dentro de la precipitación podemos encontrar que:
- Puede realizarse por una reacción química, por evaporación del disolvente, por enfriamiento repentino de una disolución caliente, o por cambio de polaridad del disolvente.
- Por otra parte, el precipitado puede englobar impurezas. En caso de desear el sólido puro, será necesario realizar procesos como cristalización, peptización, digestión, maduración y recristalización.
- Así mismo, la precipitación tiene aplicación en la separación de un componente de una mezcla, ya sea por reactividad o bien por distinta solubilidad en un determinado disolvente. Dicha separación es útil en el aislamiento de un producto de reacción.
Referencias
- ↑ Sandoval Marquéz, R. (2011). Equilibrios en disolución en química analítica (2da ed.). Universidad Nacional Autónoma de México.
- ↑ IUPAC. Compendio de terminología química, 2ª ed. (el "Libro de Oro"). Compilado por AD McNaught y A. Wilkinson. Publicaciones científicas de Blackwell, Oxford (1997). Versión en línea (2019-) creada por SJ Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ W. F. Pickering.(2021) "Química analítica moderna". Reverte. - Science. México. pp: 453-456
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.