Diferencia entre revisiones de «Equlibrios de solubilidad-precipitación»
Sin resumen de edición |
|||
| Línea 7: | Línea 7: | ||
=Introducción= | =Introducción= | ||
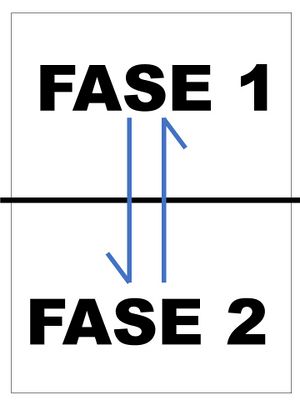
En la química analítica existe un interés por el estudio de los equilibrios heterogéneos, los cuales son aquellos en donde sus especies reactivas y productos se encuentran en más de una fase. Esto es, en la reacción intervienen sustancias en diferentes fases en forma de sólido o líquido. | En la química analítica existe un interés por el estudio de los equilibrios heterogéneos, los cuales son aquellos en donde sus especies reactivas y productos se encuentran en más de una fase. Esto es, en la reacción intervienen sustancias en diferentes fases en forma de sólido o líquido. | ||
* <big>Fase 1<sub>(s)</sub> ⇌ Fase 2<sub>(ac)</sub></big> | |||
Dentro del estudio de los equilibrios heterogéneos tenemos a los equilibrios de precipitación-solubilidad.<ref name="Sandoval">Sandoval Marquéz, R. (2011). Equilibrios en disolución en química analítica (2da ed.). Universidad Nacional Autónoma de México. pp. 380-390</ref> | Dentro del estudio de los equilibrios heterogéneos tenemos a los equilibrios de precipitación-solubilidad.<ref name="Sandoval">Sandoval Marquéz, R. (2011). Equilibrios en disolución en química analítica (2da ed.). Universidad Nacional Autónoma de México. pp. 380-390</ref> | ||
| Línea 38: | Línea 40: | ||
|} | |} | ||
=== Cálculo de la solubilidad molar === | |||
Como la solubilidad de un compuesto establece un equilibrio químico, este tiene una constante de equilibrio asociada, la cual esta expresada como: | |||
* <big>A<sub>n</sub>B<sub>m(s)</sub> ⇌ n A<sup>m+</sup> <sub>(ac)</sub> + m B<sup>n-</sup> <sub>(ac)</sub></big> | |||
* <big>K<sub>ps</sub> = [A<sup>m+</sup>]<sup>n</sup> [B<sup>n-</sup>]<sup>m</sup></big> | |||
Si en el equilibrio se han disuelto '''S''' mol por litro de soluto, entonces definimos a '''S''' como la solubilidad molar de este. | |||
Así si se disuelven S mol por litros de la sal ionica para dar S mol/L de sus iones, entonces el equilibrio se podrá reescribir como: | |||
* <big>K<sub>ps</sub> = [A<sup>m+</sup>] [B<sup>n-</sup>]</big> | |||
* <big>∴ K<sub>ps</sub> = [S] [S] = S<sup>2</sup></big> | |||
==== Ejemplos ==== | |||
=== Factores que afectan a la solubilidad === | === Factores que afectan a la solubilidad === | ||
Revisión del 07:38 15 nov 2023
Introducción
En la química analítica existe un interés por el estudio de los equilibrios heterogéneos, los cuales son aquellos en donde sus especies reactivas y productos se encuentran en más de una fase. Esto es, en la reacción intervienen sustancias en diferentes fases en forma de sólido o líquido.
- Fase 1(s) ⇌ Fase 2(ac)
Dentro del estudio de los equilibrios heterogéneos tenemos a los equilibrios de precipitación-solubilidad.[1]
El interés por el estudio de estos equilibrios radica en:
- La separación selectiva de especies químicas, con base en sus diferencias de solubilidad.
- Realizar análisis cualitativos que permiten la identificación de especies químicas, como por ejemplo detectar la presencia de plomo en vasijas de barro.
- Algunos métodos analíticos clásicos como las gravimetrías nos permiten la determinación cuantitativa de especies químicas a partir de la capacidad de formar sustancias insolubles.
Solubilidad
La IUPAC define a la solubilidad de un soluto como “Es la composición analítica de una disolución saturada, expresada en términos de la proporción de un soluto designado en un disolvente designado. La solubilidad puede expresarse como concentración, molalidad, fracción molar, etc. " [2]
Si bien esta es una definición oficial, en otras palabras, es “La cantidad máxima de un soluto que puede disolverse en una cantidad dada de un disolvente a una determinada temperatura.”
Expresión de la solubilidad
Para muchas sustancias, los valores de la solubilidad están reportados en tablas. Una forma muy común de encontrar los valores que describen cuantitativamente la solubilidad de un soluto es con el máximo número de gramos de soluto que pueden disolverse en una cantidad dada de disolvente. A partir de este dato, si conocemos la masa molar de esta sustancia, podremos expresar su solubilidad en mol por litro(mol/L o mol*L-1), a lo que se le conoce como solubilidad molar de un compuesto. Un soluto formado por iones, al disolverse en agua da lugar a cationes hidratados y aniones hidratados. En el caso particular de las sales iónicas que son poco solubles, se suele cuantificar su solubilidad mediante el estudio del equilibrio de Producto de solubilidad que se representa como Kps.
| Sal | Producto de solubilidad: Kps | Solubilidad molar: S (mol•L-1) |
|---|---|---|
| PbSO4 | 1.6 x 10-8 | 1.3 x 10-4 |
| AgCl | 1.0 x 10-6 | 1.0 x 10-5 |
| AgBr | 4.0 x 10-13 | 6.0 x 10-7 |
| AgI | 1.0 x 10-16 | 1.0 x 10-8 |
Cálculo de la solubilidad molar
Como la solubilidad de un compuesto establece un equilibrio químico, este tiene una constante de equilibrio asociada, la cual esta expresada como:
- AnBm(s) ⇌ n Am+ (ac) + m Bn- (ac)
- Kps = [Am+]n [Bn-]m
Si en el equilibrio se han disuelto S mol por litro de soluto, entonces definimos a S como la solubilidad molar de este. Así si se disuelven S mol por litros de la sal ionica para dar S mol/L de sus iones, entonces el equilibrio se podrá reescribir como:
- Kps = [Am+] [Bn-]
- ∴ Kps = [S] [S] = S2
Ejemplos
Factores que afectan a la solubilidad
En los equilibrios de precipitación-solubilidad existen diversos factores que pueden modificar el comportamiento de la reacción, haciendo que estos favorezcan la formación de reactivos o productos, según sea el caso. A continuación, haremos un análisis de diferentes escenarios que pueden modificar a los sistemas en equilibrio de solubilidad-precipitación, los cuales son:
- Efecto de la estequiometría.
- Efecto de un ion común
- Efecto del pH.
Efecto de la estequiometría
La solubilidad molar no necesariamente tiene que ser directamente proporcional al valor de la constante de equilibrio Kps, ya que es dependiente de la estequiometría de la sal que estemos analizando. Esto se debe a que la concentración de los iones formados al disociarse la sal, deben estar elevados al valor de su coeficiente estequiométrico.
Ejemplos
| Sal | Estequiometría | Kps | Solubilidad molar (mol/L) |
|---|---|---|---|
| AgCl | 1:1 | 1.80 x 10-10 | 1.34 x 10-5 |
| AgBr | 1:1 | 5.00 x 10-13 | 7.07 x 10-7 |
| AgI | 1:1 | 8.30 x 10-17 | 9.11 x 10-9 |
| Sal | Estequiometría | Kps | Solubilidad molar (mol/L) |
|---|---|---|---|
| Cu(OH)2 | 1:2 | 4.80 x 10-20 | 3.63 x 10-7 |
| Ca(OH)2 | 1:2 | 6.50 x 10-6 | 0.0186 |
| Fe(OH)3 | 1:3 | 1.60 x 10-39 | 2.00 x 10-10 |
| Al(OH)3 | 1:3 | 3.00 x 10-34 | 4.16 x 10-9 |
| Sal | Estequiometría | Kps | Solubilidad molar (mol/L) |
|---|---|---|---|
| FeS | 1:1 | 8.00 x 10-19 | 8.94 x 10-10 |
| MgF2 | 3:1 | 7.40 x 10-9 | 1.94 x 10-3 |
| Ag3PO4 | 1:3 | 2.80 x 10-18 | 4.09 x 10-5 |
| Pb3(PO4) 2 | 3:2 | 3.00 x 10-44 | 1.97 x 10-9 |
Es importante recordar que, aunque hay una estrecha relación entre el valor de Kps y el valor de la solubilidad molar, no podemos dejarnos llevar solo por el valor de la Kps. Es importante considerar la estequiometría de los compuestos que estemos analizando como lo hemos hecho ahora en los diferentes ejemplos.
Por lo que la Kps y la solubilidad molar es distinta en cada caso particular.
Efecto de un ion común
Dentro del estudio de la Química Analítica, la ley de acción de masas nos dice que, si aumenta la concentración de los productos, el equilibrio tenderá a favorecer la formación los reactivos. Si hay exceso de un ion sobre el otro, la concentración de este último se abate, conocido como efecto del ion común. Esto afecta a la solubilidad del precipitado, lo que hará que disminuya su concentración.
Ejemplo
Planteemos el siguiente sistema[1]. Una disolución saturada de bromuro de plata en la cual se le añade una disolución de bromuro de sodio. El cual podeos expresar en el siguiente equilibrio:
- AgBr(s) ⇌ Ag+ (ac) + Br- (ac)
- NaBr(s) ⇌ Na+ (ac) + Br- (ac)
El ion común es el ion bromuro (Br-).
Al determinar la solubilidad del bromuro de plata obtenemos que:
Kps = [Ag+][Br-] = 5.00x10-13
Kps = S * S = S2
∴ S = √(Kps) = √(5.00x10-13)= 7.07x10-7 mol/L
Si al sistema adicionáramos una disolución de Bromuro de sodio 0.001 mol/L, al determinar la solubilidad obtendremos que:
[Br-] = 0.001 mol/L
Sustituyendo el valor de los iones bromuros en el cálculo de solubilidad,
Kps = [Ag+][Br-]
Kps = S * [Br-]
∴ = 5.00x10-10 mol/L
En conclusión, podemos observar que la solubilidad molar se verá disminuida en presencia del ion común:
| En presencia de la disolución de NaBr 0.001 mol/L | En ausencia de la disolución de NaBr 0.001 mol/L |
|---|---|
| S = 5.00x10-10 mol/L | S = 7.07x10-7 mol/L |
Efecto del pH
En muchos casos, los aniones que conforman una sal poco soluble tienen características marcadamente básicas, es decir, tienen una gran afinidad por el protón.
El ejemplo más sencillo de esta situación lo constituyen los hidróxidos. El ion hidróxido forma sustancias poco solubles como los que observamos en las tablas al inicio del vídeo, sin embargo, considera que los hidróxidos formados con los iones metálicos de la familia IA si son solubles.
Ejemplo
Planteemos el siguiente sistema[1]. El equilibrio de hidróxido de hierro (III).
- Fe(OH)3(s) ⇌ Fe3+ (ac) + 3 OH- (ac)
- Kps = [Fe3+][OH-]3 = 1.60 x 10-39
Al plantear el equilibrio, podemos observar que el hidróxido de hierro (III) se disocia en un ion hierro 3+ y en 3 iones hidróxido. Esto significa que el ion hierro tenderá a precipitar como hidróxido al encontrarse en un medio abundante en iones hidróxido, es decir, alcalino. Sin embargo, el principio de Le Châtelier nos dice que, si disminuye la concentración de alguno de los productos, el equilibrio de desplazará hacia la formación de productos.
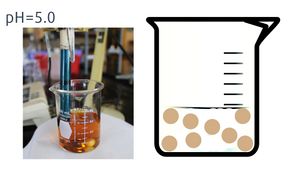
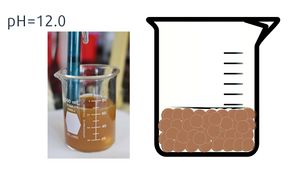
En este caso particular, la adición de protones al medio elimina los iones hidroxilo, formando agua, lo que genera un aumento en la concentración de los iones hierro 3+ en la disolución. Para este ejemplo calculemos cuál sería la solubilidad molar del ion hierro 3+ en una disolución saturada de hidróxido de hierro (III), analizando su solubilidad molar en un medio amortiguado a pH= 1, a pH=5 y uno a pH= 12.
- Sistema amortiguado a pH = 1.0
Si tenemos un valor fijo de pH = 1.0
[H+] = 10-1 mol/L ; [OH-] = 10-13 mol/L
Kps = [Fe3+] [OH-]3 = 1.60 x 10-39
Kps = [Fe3+] [10-13 mol/L]3
∴ [Fe3+] = [1.60 x 10-39] / [10-13 mol/L]3 = 1.60 mol/L
- Sistema amortiguado a pH = 5.0
Si tenemos un valor fijo de pH = 5.0
[H+] = 10-5 mol/L ; [OH-] = 10-9 mol/L
Kps = [Fe3+] [OH-]3 = 1.60 x 10-39
Kps = [Fe3+] [10-9 mol/L]3
∴ [Fe3+] = [1.60 x 10-39] / [10-9 mol/L]3 = 1.60 x 10-12 mol/L
- Sistema amortiguado a pH = 12.0
Si tenemos un valor fijo de pH = 12.0
[H+] = 10-12 mol/L ; [OH-] = 10-2 mol/L
Kps = [Fe3+] [OH-]3 = 1.60 x 10-39
Kps = [Fe3+] [10-2 mol/L]3
∴ [Fe3+] = [1.60 x 10-39] / [10-2 mol/L]3 = 1.60 x 10-33 mol/L
| A pH = 1.0 | A pH = 5.0 | A pH = 12.0 |
|---|---|---|
| [Fe3+] = 1.60 mol/L | [Fe3+] = 1.60 x 10-12 mol/L | [Fe3+] = 1.60 x 10-33 mol/L |
El hidróxido de hierro (III) es una sal insoluble en agua en pH básicos. La formación del precipitado fue favorecida conforme fuimos aumentando el pH, al añadir una disolución de hidróxido de sodio a nuestra disolución. La presencia del ion hidróxido modificó nuestro equilibrio, favoreciendo la formación de precipitado a pH básicos. Esto es lo que conocemos como el efecto del pH.
Producto de solubilidad
La IUPAC define al equilibrio de solubilidad, también llamado producto de solubilidad, como el producto de las actividades iónicas elevadas a las potencias apropiadas de un soluto iónico en su disolución saturada, expresado con la debida referencia a los equilibrios de disociación implicados y a los iones presentes.[5]
Ecuación química
Planteemos un equilibrio general:
- AnBm(s) ⇌ n Am+ (ac) + m Bn- (ac)
- Kps = [Am+]n [Bn-]m
Ejemplos
- AgCl(s) ⇌ Ag+ (ac) + Cl- (ac) ; Kps = [Ag+] [ Cl-] = 1.80 x 10 -10
- Cu(OH)2(s) ⇌ Cu2+ (ac) + 2 OH- (ac) ; Kps = [Cu2+] [ OH-]2 = 3.63 x 10 -7
- Pb3(PO4)2(s) ⇌ 3 Pb2+ (ac) + 2 PO4 3- (ac) ; Kps = [Pb2+]3 [ PO4 3-]2 = 3.00 x 10 -44
Disolución saturada
La IUPAC la define como “Una disolución que tiene la misma concentración de un soluto que una que está en equilibrio con un soluto no disuelto a valores específicos de temperatura y presión.”[6]
Esta es una constante de equilibrio de la reacción de disociación de un sólido salino. En la constante de equilibrio de solubilidad durante los cálculos de equilibrios de especies iónicas con precipitación, la actividad de los sólidos en contacto con la disolución se considera como unitaria, por lo cual no es necesario escribirlo de forma explícita.
Precipitación
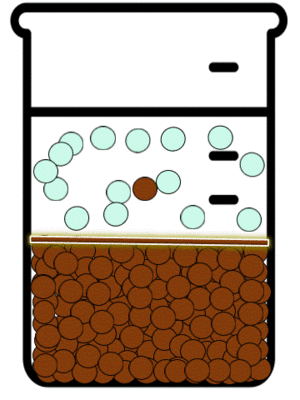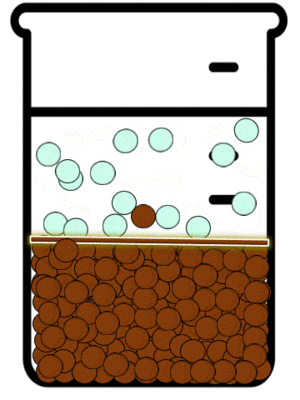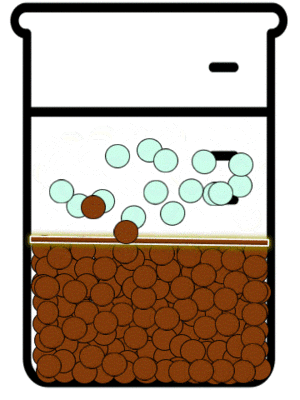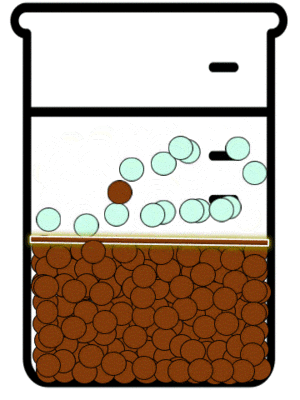
Las sustancias iónicas solubles existen en disolución en la forma de aniones y cationes. Estos iones en disolución están en continuo movimiento y debido a ello interactúan momentáneamente. Dependiendo de que tan soluble sea en agua la sustancia a la que corresponden el catión y el anión, mientras no sea una disolución saturada, la interacción entre los iones no será suficiente como para producir agregados de iones en forma de sólidos cristalinos. La IUPAC define a La precipitación como “la sedimentación de un material sólido (un precipitado) a partir de una disolución líquida en la que el material está presente en cantidades superiores a su solubilidad en el líquido."[7]
Dentro de la precipitación podemos encontrar que:
- Puede realizarse por una reacción química, por evaporación del disolvente, por enfriamiento repentino de una disolución caliente, o por cambio de polaridad del disolvente.
- Por otra parte, el precipitado puede englobar impurezas. En caso de desear el sólido puro, será necesario realizar procesos como cristalización, peptización, digestión, maduración y recristalización.
- Así mismo, la precipitación tiene aplicación en la separación de un componente de una mezcla, ya sea por reactividad o bien por distinta solubilidad en un determinado disolvente. Dicha separación es útil en el aislamiento de un producto de reacción.
Equilibrio de precipitación
Las reacciones de precipitación son aquellas en las que se formamos una especie química, cuya característica principal es su solubilidad limitada. Durante la reacción química, lo que sucede es que las especies reactivas en disolución inicia la formación de partículas extremadamente pequeñas, las cuales posteriormente crecen y finalmente se separan de a disolución. Esto se puede observar mediante la aparición de un sólido, llamado precipitado.[8]
En dichas reacciones estudiamos los equilibrios de precipitación. Este tipo de equilibrios se definen como aquellos que se establecen cuando se adiciona a una especie en disolución otra que puede formar un precipitado.
Referencias
- ↑ 1,0 1,1 1,2 Sandoval Marquéz, R. (2011). Equilibrios en disolución en química analítica (2da ed.). Universidad Nacional Autónoma de México. pp. 380-390
- ↑ IUPAC. Compendio de terminología química, 2ª ed. (el "Libro de Oro"). Compilado por AD McNaught y A. Wilkinson. Publicaciones científicas de Blackwell, Oxford (1997). Versión en línea (2019-) creada por SJ Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ Gary D., C. (2009), Química Analítica. 6ta. Edición. Mc Graw Hill. pp. 328
- ↑ 4,0 4,1 4,2 Harris, D. (2007). Quantitative Chemical Analysis (7ma Edición). W. H. Freeman and Company. APPENDIX F: Solubility Products pág. AP9-AP10
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook.
- ↑ W. F. Pickering.(2021) "Química analítica moderna". Reverte. - Science. México. pp: 453-456

![{\displaystyle S={\frac {Kps}{[Br^{-}]}}={\frac {5.00x10^{-}13}{0.001}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0d6f54dfaf103fb01334c4b6eebe6e74478d78ff)