Teoria Brønsted-Lowry
A lo largo de la historia se han propuesto varias teorías ácido-base para entender o clasificar las propiedades ácidas o básicas de las diferentes sustancias que nos rodean. Muchas partieron de lo más general a lo más específico, por lo que cabe mencionar que no todas las teorías ácido-base son aplicables a todos los compuestos, ya que muchas de ellas están condicionadas a ciertos sistemas.[1]
Las primeras definiciones de ácidos y de bases estaban descritas a partir de la percepción de los sentidos: los ácidos tienen sabor agrio y de textura aceitosa, mientras las bases tienen un sabor muy amargo y de textura jabonoso, y en los cambios de color que producían en algunos pigmentos vegetales.
Introducción
En 1923, Johannes Nicolaus Bronsted, químico y físico danés (22 de febrero de 1879-17 de diciembre de 1947) y Thomas Martin Lowry, físico y químico inglés (26 de octubre de 1874 – 2 de noviembre de 1936) fueron los cientificos que definen y proponen de manera independiente el comportamiento de los ácidos y bases en la teoría que hoy es conocida como "Teoría de Brønsted-Lowry".[1]
Dicha teoría ha sido, es y será de gran utilidad para el estudio del comportamiento de las sustancias con características ácido-base dentro de las diferentes ramas de la Química.
Ácidos
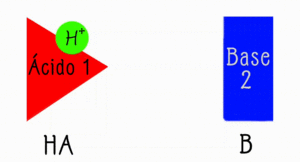
Esta teoría define como un ácido a cualquier sustancia capaz de donar un protón.
Algo muy importante de destacar del concepto de Brønsted-Lowry es que el producto que se forma cuando un ácido dona un protón se convierte en un receptor potencial de protones y es a lo que conocemos como base conjugada del ácido. Esta relación entre el reactivo y producto formado se le conoce como el par ácido-base conjugado o par conjugado.[2], el cual esta representado en el siguiente equilibrio:
- ácido ⇌ base conjugada + H+
Ejemplos
Algunos ejemplos de ácidos de Brønsted-Lowry son los siguientes:
Bases
Esta teoría define como una base a cualquier sustancia capaz de aceptar un protón.
Al igual que los ácidos, algo muy importante de destacar que el producto que se forma cuando una base acepta un protón se convierte en un donador potencial de protones y es a lo que conocemos como ácido conjugado de la base. Esta relación entre el reactivo y producto formado también se le conoce como el par ácido-base conjugado o par conjugado.[2], la cual está representada en el siguiente equilibrio:
- base + H+ ⇌ ácido conjugado
Ejemplos
Algunos ejemplos de bases de Brønsted-Lowry son los siguientes:
Reacción ácido-base
Cuando los ácidos y las bases en la Teoría de Brønsted-Lowry interaccionan en un mismo equilibrio da como resultado lo que llamamos como reacciones ácido-base o reacción de neutralización, el cual esta descrito en el siguiente equilibrio[2]:
- ácido1 + base1 ⇌ base2 (conjugada) + ácido2 (conjugado)
Ejemplos
En la naturaleza contamos con una gran variedad de ejemplos, como la siguiente reacción ácido-base:
Donde:
- El ácido acético (), es una sustancia que es considerada como un ácido. Esto debido a que dona un protón al agua ().
- El ácido acético () se convierte en su base conjugada al perder un protón, dando como producto al ion acetato ().
- El agua () es una sustancia que se considera una base.
- El agua () acepta un protón del y se convierte en un ácido conjugado, formando el ion hidronio ()
Otros ejemplos de reacciones ácido-base son: