Ligante
Un Agente quelante, Agente complejante, Donador, Ligando o Ligante, es una molécula con la capacidad de formar un complejo con un ion metálico, atrapando el ion en su estructura molecular. Este complejo formado recibe el nombre de Quelato.
Se les denomina donantes al describirse como Bases de Lewis, pues uno o más átomos cuentan con la capacidad de donar al menos un par de electrones a un ión metálico.
El átomo donante dentro del ligando es aquel que posee el par de electrones.
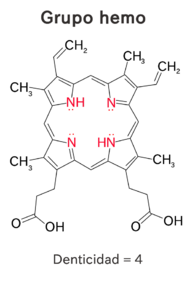
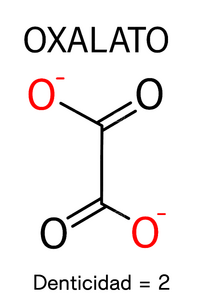
Denticidad
La denticidad es un concepto que hace referencia a la capacidad de un ligando para donar n cantidad de pares de electrones al ión metálico. La Denticidad hace referencia a aquellos Agentes Quelantes capaces de donar múltiples electrones. Dependiendo del número de donantes dentro de la molécula, el compuesto puede definirse como Bidentado o Polidentado.
La denticidad proporcional al número de pares de electrones libres del ligante, es decir, si el ligando tiene un par de electrones libres para coordinarsse con el ión metálico, se dice que su denticidad es igual a 1, si posee dos pares de electrones libres, su denticidad es igual a 2 y así sucesivamente. Podemos clasificar los compuestos según su denticidad.
| Nombre | Definición | Ejemplo |
|---|---|---|
| Monodentado | El átomo donante posee un par de electrones libres para unirse al ión metálico. | NH4+ |
| Bidentado | El ligando posee dos átomos donantes, por lo que posee dos pares de electrones libres para unirse al ión metálico. | |
| Polidentado | El ligando posee cuatro o más átomos donantes, por lo que posee más de cuatro pares de electrones libres para unirse al ión metálico |
Valencia
La valencia o número de oxidación hace referencia a la carga eléctrica que un átomo tiene. Es el número máximo de átomos univalentes que pueden combinarse con un átomo de otro elemento o bien, que pueden sustituirse por un átomo de este. <ref>IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://goldbook.iupac.org/terms/view/V06588.Error en la cita: La etiqueta de apertura <ref> es incorrecta o tiene el nombre mal
Representa la carga que tomaría el átomo si todos los enlaces estuvieran rotos <ref>Gaston C., (S.F.), Química analítica general: Soluciones acuosas y no acuosas, vol I, (2a Ed.), Toray-MassonError en la cita: La etiqueta de apertura <ref> es incorrecta o tiene el nombre mal
Se denomina también como número de oxidación debido a que comunmente se relaciona con la interación de oxígeno a una molécula "oxidando" así el compuesto. Conocer el número de oxidación permite determinar el estado de oxidación de los elementos.
Se habla de una molécula con carga neutra cuando la suma algebráica del número de oxidación (cargas) de los iones que la forman, es nula. <ref>Gaston C., (S.F.), Química analítica general: Soluciones acuosas y no acuosas, vol I, (2a Ed.), Toray-MassonError en la cita: La etiqueta de apertura <ref> es incorrecta o tiene el nombre mal
(((Un número de oxidación positivo demuestra que existe un menor número de electrones de la capa externa.
Un número de oxidación negativo no puede ser inferior al número de electrones necesarios para saturar la capa externa.<ref>Gaston C., (S.F.), Química analítica general: Soluciones acuosas y no acuosas, vol I, (2a Ed.), Toray-MassonError en la cita: La etiqueta de apertura <ref> es incorrecta o tiene el nombre mal
)))
Ejemplos
Permanganato de potasio: KMnO4 K1+, 4O2-, Mn7+ Ión dicromato: Cr2O72-: 7O2-, 2Cr6-
| Ejemplo | Suma algebráica | Valencia |
|---|
Quelato
Los quelatos o complejos quelados son entidades moleculares donde existe quelación. Son sustancias que forman enlaces entre dos o más sitios de unión del mismo ligando y un solo átomo central.
Referencias
1. Christian, G. D. (2009). Química analítica (6a. ed.). McGraw-Hill Interamericana. pp: 297. https://ebookcentral.proquest.com/lib/bibliodgbmhe/reader.action?docID=3214376 2. IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://goldbook.iupac.org/terms/view/E01988 3. IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://goldbook.iupac.org/terms/view/D01594. IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. A. . Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. {{reflistvalencia |refs= <ref name="IUPAC">Plantilla:Cita web