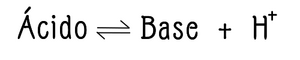Diferencia entre revisiones de «Teoría Ácido Base de Brønsted-Lowry»
Ir a la navegación
Ir a la búsqueda
Sin resumen de edición |
Sin resumen de edición |
||
| (No se muestran 5 ediciones intermedias del mismo usuario) | |||
| Línea 1: | Línea 1: | ||
Los ácidos son cuerpos capaces de ceder protones<ref>Gaston C., (S.F.), Química analítica general: Soluciones acuosas y no acuosas, vol I, (2a Ed.), Toray-Masson</ref> | [[Archivo:Relación Ácido Base_Charlot.png|miniaturadeimagen|Representación de la relación par ácido-base]] | ||
Los ácidos son cuerpos capaces de ceder protones en presencia de una base capaz de fijarlos<ref>Gaston C., (S.F.), Química analítica general: Soluciones acuosas y no acuosas, vol I, (2a Ed.), Toray-Masson</ref> | |||
==Fuerza de ácidos y bases== | |||
Ácido1 + Base2 --> Base1 + Ácido2 | |||
La reacción desplazada de este lado indica que lo que reacciona es Ác1 y Base2, por lo que Ácido1 es más fuerte que ácido2 | |||
Base2 reacciona con ácido1, por lo que es más fuerte que Base1. | |||
A un ácido fuerte siempre corresponde una base débil y a la inversa. | |||
==Referencias== | ==Referencias== | ||
{{reflist}} | {{reflist}} | ||
Revisión actual - 13:53 21 jun 2023
Los ácidos son cuerpos capaces de ceder protones en presencia de una base capaz de fijarlos[1]
Fuerza de ácidos y bases
Ácido1 + Base2 --> Base1 + Ácido2
La reacción desplazada de este lado indica que lo que reacciona es Ác1 y Base2, por lo que Ácido1 es más fuerte que ácido2
Base2 reacciona con ácido1, por lo que es más fuerte que Base1.
A un ácido fuerte siempre corresponde una base débil y a la inversa.
Referencias
- ↑ Gaston C., (S.F.), Química analítica general: Soluciones acuosas y no acuosas, vol I, (2a Ed.), Toray-Masson
- ↑ IUPAC. Compendium of Chemical Terminology, 2nd ed. (the "Gold Book"). Compiled by A. D. McNaught and A. Wilkinson. Blackwell Scientific Publications, Oxford (1997). Online version (2019-) created by S. J. Chalk. ISBN 0-9678550-9-8. https://doi.org/10.1351/goldbook
- ↑ Christian, G. D. (2009). Química analítica (6a. ed.). McGraw-Hill Interamericana. https://ebookcentral.proquest.com/lib/bibliodgbmhe/reader.action?docID=3214376
- ↑ Burgot, Jean-Lois, Ionic Equilibria in Analytical Chemistry, https://link-springer-com.pbidi.unam.mx:2443/book/10.1007/978-1-4419-8382-4
- ↑ Petrucci, R. H. (2010). QUIMICA GENERAL (10th ed.). Pearson HispanoAmerica Contenido. https://bookshelf-ref.vitalsource.com/books/9788483226803
- ↑ Gaston C., (S.F.), Química analítica general: Soluciones acuosas y no acuosas, vol I, (2a Ed.), Toray-Masson