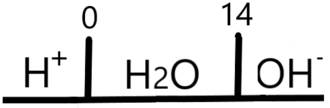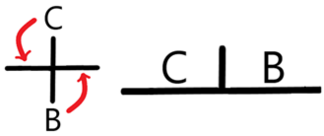Diferencia entre revisiones de «Equilibrios Ácido-Base»
(He creado esta página para los equilibrios ácido-base) |
(Avance en Equilibrios Ácido-Base) |
||
| Línea 2: | Línea 2: | ||
En relación con el empleo de las constantes de disociación, generalmente se utilizan las siguientes reacciones: | En relación con el empleo de las constantes de disociación, generalmente se utilizan las siguientes reacciones: | ||
<chem display="block">H3A <=> H2A^- + H^+ ....K_a_3</chem><chem display="block">H2A^- <=> HA^2- + H^{+} .... K_a_2</chem><chem display="block">HA^2- <=> A^3- + H^+ .... K_a_1</chem>Donde <chem display="inline">Ka_{n} </chem> se refiere a la constante de | <chem display="block">H3A <=> H2A^- + H^+ ....K_a_3</chem><chem display="block">H2A^- <=> HA^2- + H^{+} .... K_a_2</chem><chem display="block">HA^2- <=> A^3- + H^+ .... K_a_1</chem>Donde <chem display="inline">Ka_{n} </chem> se refiere a la '''constante de acidez''' de la especie <chem display="inline">H_{n}A </chem> que aún contiene <chem display="inline">n </chem> partículas de hidrógeno por liberar. Si <chem display="inline">n = 1 </chem> entonces estamos trabajando con un '''ácido monoprótico''' (ej. <chem>HCl, HF, HNO3, </chem> etc.), en cambio si <chem display="inline">n > 1 </chem> entonces estamos trabajando con '''ácidos polipróticos''' (<chem>H2SO4, H3PO4, H3Cit </chem> donde <chem>Cit </chem> se refiere al citrato). | ||
Cuando trabajamos | Cuando trabajamos con ácidos polipróticos resulta conveniente trabajar con la '''constante de formación global''' para cada especie en lugar de las constantes de acidez debido a que ya las engloba. Estas constantes globales responden a las siguientes formaciones: | ||
<chem display="block">A^3- + 3 H^+ <=> H3A ....\beta_3 = \frac{1}{Ka_{1}Ka_{2}Ka_{3}} </chem><chem display="block">A^3- + 2 H^+ <=> H2A^- ....\beta_2 = \frac{1}{Ka_{1}Ka_{2}} </chem><chem display="block">A^3- + H^+ <=> HA^2- ....\beta_1 = \frac{1}{Ka_1} </chem>Donde <chem display="inline">\beta_n </chem> se refiere a la constante global de formación para la especie <chem display="inline">H_{n}A </chem>. | |||
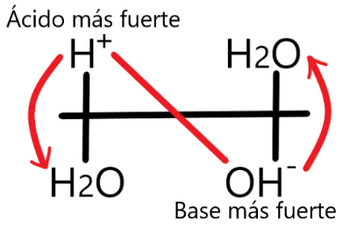
== Diagrama Unidimensional de Zona de Predominio (DUZP) == | == Diagrama Unidimensional de Zona de Predominio (DUZP) == | ||
[[Archivo:DUZP agua.png|alt=DUZP del agua|miniaturadeimagen|350x350px|DUZP marcando la regla de la N para el proceso más termodinámicamente favorable]] | |||
El DUZP se construye ordenando a los pares ácido-base según sus valores de <chem display="inline">pKa </chem> ubicando a los donadores de protones o ácidos (<chem display="inline">H+ </chem>) por encima y a los receptores o bases por debajo de la recta. En los extremos de la recta colocamos a los pares ácido-base del agua coronándolos como los más fuertes en su categoría y marcándolos como límites de la misma (0 y 14, de acuerdo al pH). | |||
Siguiendo '''la regla de la N''' se obtiene el proceso más termodinámicamente favorable y cuya constante de reacción (<chem display="inline">Kr </chem>) se define como: | |||
<math display="block">Kr = 10^{pKa_2 - pKa_1}</math> | |||
Si la reacción a estudiar sigue una dirección opuesta a esta regla entonces estará ante un proceso termodinámicamente desfavorecido cuya Kr se invierte. | |||
=== Anfolitos inestables === | |||
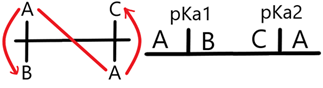
Puede suceder (y lo hará) que aparezcan anfolitos inestables, en ese caso deberá de eliminarlos antes de proceder de cualquier forma. Sabes que hay uno cuando el DUZP muestra a la misma especie en dos zonas distintas o bien que la reacción entre sus especies es termodinámicamente favorable. | |||
Así se ve el DUZP del agua: | |||
[[Archivo:Imagen8.png|alt=DUZP|centro|miniaturadeimagen|330x330px|DUZP sin anfolitos inestables]] | |||
Nótese que no tiene anfolitos inestables. Ahora así se ve uno que sí los tiene: | |||
[[Archivo:DUZP con anfolitos inestables.png|alt=DUZP|centro|miniaturadeimagen|324x324px|DUZP con anfolitos inestables]] | |||
Nótese la aberración en el diagrama. Para resolverlo tenemos que plantear la reacción del anfolito y obtenemos la media de sus <chem display="inline">pKa </chem> con un análisis de reactividad. Entonces… | |||
== | <chem display="block">2 A <=> B + C .... pKr = \frac{pKa1 + pKa2}{2} </chem>Obteniendo así un nuevo diagrama sin el anfolito conflictivo. | ||
[[Archivo:Anfolito.png|alt=DUZP corregido|centro|miniaturadeimagen|324x324px|DUZP tras corregir al anfolito inestable]] | |||
== Conversión de pOH a pH en un DUZP == | === Conversión de pOH a pH en un DUZP === | ||
== Ecuaciones de Charlotte == | == Ecuaciones de Charlotte == | ||
Revisión del 17:02 10 ene 2026
Equilibrios de disociación sucesiva y de formación global
En relación con el empleo de las constantes de disociación, generalmente se utilizan las siguientes reacciones:
Cuando trabajamos con ácidos polipróticos resulta conveniente trabajar con la constante de formación global para cada especie en lugar de las constantes de acidez debido a que ya las engloba. Estas constantes globales responden a las siguientes formaciones:
Diagrama Unidimensional de Zona de Predominio (DUZP)
El DUZP se construye ordenando a los pares ácido-base según sus valores de ubicando a los donadores de protones o ácidos () por encima y a los receptores o bases por debajo de la recta. En los extremos de la recta colocamos a los pares ácido-base del agua coronándolos como los más fuertes en su categoría y marcándolos como límites de la misma (0 y 14, de acuerdo al pH).
Siguiendo la regla de la N se obtiene el proceso más termodinámicamente favorable y cuya constante de reacción () se define como:
Si la reacción a estudiar sigue una dirección opuesta a esta regla entonces estará ante un proceso termodinámicamente desfavorecido cuya Kr se invierte.
Anfolitos inestables
Puede suceder (y lo hará) que aparezcan anfolitos inestables, en ese caso deberá de eliminarlos antes de proceder de cualquier forma. Sabes que hay uno cuando el DUZP muestra a la misma especie en dos zonas distintas o bien que la reacción entre sus especies es termodinámicamente favorable.
Así se ve el DUZP del agua:
Nótese que no tiene anfolitos inestables. Ahora así se ve uno que sí los tiene:
Nótese la aberración en el diagrama. Para resolverlo tenemos que plantear la reacción del anfolito y obtenemos la media de sus con un análisis de reactividad. Entonces…