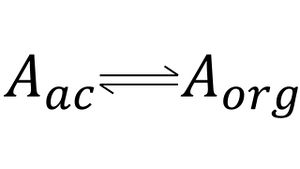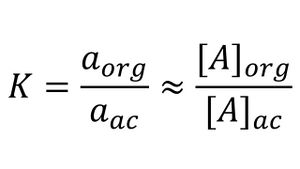Extracción liquido-liquido
Definición
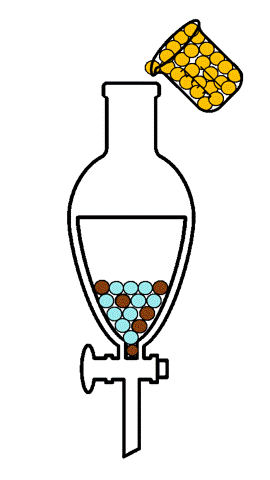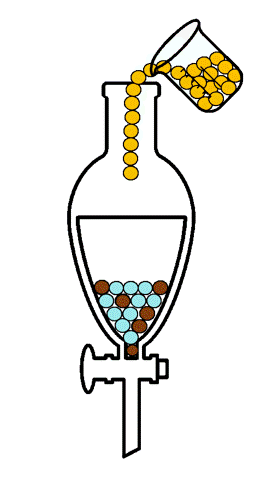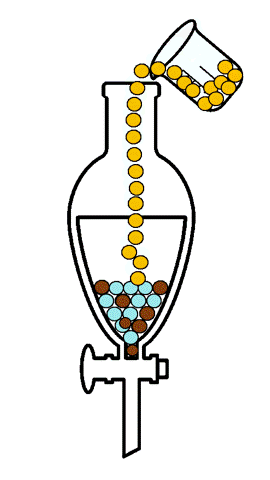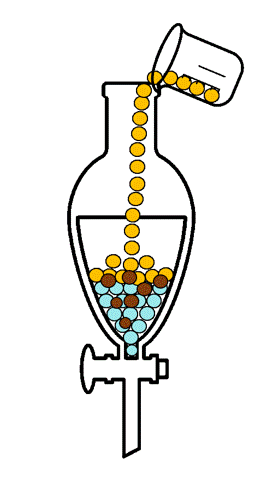
La extracción líquido-líquido, también llamada extracción con disolventes, consiste en la separación de los constituyentes de una mezcla líquida por contacto con otro líquido inmiscible (parcial o totalmente inmiscible), por lo tanto, no supone cambio de estado físico. Si los componentes de la mezcla original se distribuyen de forma diferenciada entre las dos fases líquidas, se produce un cierto grado de separación, que puede acentuarse por la combinación de etapas múltiples, tal como ocurre en operaciones como la destilación o la absorción. [1]
En la extracción líquido-líquido, una alimentación líquida de dos o más componentes se pone en contacto con una segunda fase líquida, llamada disolvente, que tiene mayor afinidad por uno de ellos, siendo la característica que permite la separación. Por lo tanto, el disolvente incorpora parcialmente ciertas especies de la alimentación líquida, efectuando al menos una separación parcial de los componentes de la alimentación. El estudio experimental del equilibrio de fases líquido-líquido de sistemas multicomponentes es de gran importancia, ya que se requiere que los disolventes elegidos sean no tóxicos para el proceso, más eficientes, más baratos, menos corrosivos y más selectivos. Por esta razón es indispensable contar con datos experimentales confiables de equilibrio de fases líquido-líquido de los compuestos de interés.[2]
Contexto histórico
La extracción se ha practicado desde la época de los Romanos, utilizaban plomo fundido para separar el oro y la plata del cobre fundido por extracción. Esto fue seguido por el descubrimiento de que el azufre podría disolver selectivamente la plata de una aleación con oro. Sin embargo, no fue hasta la década de 1930 que L. Edeleanu inventó el primer proceso de extracción a gran escala, se trató de la eliminación de compuestos aromáticos y azufre del queroseno líquido utilizando dióxido de azufre líquido de 10° a 20 ° F. Esto dio lugar a un queroseno de combustión más limpia. La extracción líquido-líquido ha crecido en importancia desde entonces, debido a la demanda de los productos sensibles a la temperatura, los requisitos de mayor pureza, mejor equipo, y es un método usado con frecuencia en bioseparadores.[3]
Principio de Ley de distribución
La partición de un soluto entre dos fases inmiscibles es un proceso de equilibrio químico que está gobernado por la ley de distribución.[4] Si se permite que la especie química del soluto A se distribuya entre una fase orgánica y una acuosa, el equilibrio químico resultante se puede escribir como:
Donde los subíndices se refieren a las fases acuosa y orgánica, respectivamente. De modo ideal, la relación de las actividades para A en las dos fases será constante e independiente de la cantidad total de A, de tal manera que a cualquier temperatura dada:
donde aorg y aac son las actividades de A en cada una de las fases, y los términos entre corchetes son las concentraciones molares de A. Así como con muchos otros equilibrios químicos, las concentraciones molares en muchas condiciones se pueden sustituir por las actividades sin provocar errores graves, La constante de equilibrio químico K se conoce como la constante de distribución. Por lo general, el valor numérico para K aproxima la relación de la solubilidad de A en cada disolvente. Las constantes de distribución son útiles, dado que permiten llevar a cabo cálculos de la concentración del analito restante en la disolución después de cierto número de extracciones.[5]
Aplicaciones
Las aplicaciones de la extracción líquida se clasifican en varias categorías: aquellas aplicaciones en que la extracción está en competencia directa con otros métodos de separación y aquellas aplicaciones en que es el único método adecuado para separar. Algunos ejemplos son[6]:
- Como sustituto de la destilación o evaporación, cuando las sustancias a separar son químicamente diferentes.
Por ejemplo, el ácido acético puede separarse de disoluciones diluidas en agua a costes relativamente elevados por rectificación, sin embargo, se puede separar con relativa facilidad y menores costes por extracción seguida de rectificación del extracto.
- Para separaciones que no son fáciles o posibles por otras técnicas.
Por ejemplo, la separación de hidrocarburos aromáticos y parafínicos de pesos moleculares próximos (y por tanto parecidos puntos de ebullición) es muy sencilla por extracción con distintos disolventes, como el dióxido de azufre y destilen glicol, pero es prácticamente imposible por destilación ya que las presiones de vapor son muy parecidas. Muchos productos farmacéuticos (como la penicilina) se obtienen de mezclas tan complejas, que su separación solo es posible por extracción.
- Muchas separaciones de metales, en particular aquéllas costosos y difíciles por medios químicos (como vanadio-uranio, hafnio-circonio) se pueden llevar a cabo económicamente por extracción. Incluso productos inorgánicos de bajo coste tales como el ácido fosfórico, bórico o hidróxido sódico se purifican
por extracción con disolventes.
- Los procesos de extracción supercrítica que permiten la recuperación de distintas sustancias como la cafeína, etc. utilizando básicamente el dióxido de carbono supercrítico como disolvente.
Referencias
- ↑ Mancilla Gomis, A. (1999). Introducción a las operaciones de separación. Contacto continuo (1ra ed.). Compobell, S.L.
- ↑ Perry, Robert H. & Don W. Green. (2001). Manual del Ingeniero Químico. Madrid: McGraw.Hill.
- ↑ Treybal, Robert E. (1968). Extracción en Fase Líquida. México: UTEHA.
- ↑ Skoog, D. A., West, D. M., Holler, F. J., & Crouch, S. R. (2015). Fundamentos de química analítica (9a. ed.). México D.F.: Cengage Learning.
- ↑ Skoog, D. A., West, D. M., Holler, F. J., & Crouch, S. R. (2015). Fundamentos de química analítica (9a. ed.). México D.F.: Cengage Learning.
- ↑ Seader, J. D. & Ernest J. Henley. (2006). Separation Process Principles. USA: John Wiley & Sons, Icn.